2021年5月7日 12:03
2021年第一季度产品收入共计1.061亿美元;相比较,去年同期为0.521亿美元
自新版国家医保药品目录2021年3月正式执行以来,百泽安®、百悦泽®和安加维®的市场需求显著增加
与诺华就百泽安®达成的合作与授权协议正式生效且由此获得6.5亿美元预付款
广州生物药生产基地于3月获准商业化生产,进一步提升百泽安®在中国的市场供应以及公司总体战略能力
美国麻省剑桥和中国北京——2021 年 5 月 7 日——百济神州(纳斯达克代码:BGNE;香港联交所代码:06160)是一家全球化的生物科技公司,专注于在世界范围内开发和商业化创新药物。公司今日公布近期业务亮点、预计里程碑事件以及 2021 年第一季度财务业绩。
百济神州创始人、首席执行官兼董事长欧雷强(John V. Oyler)先生表示:“2021 年第一季度, 公司在多项关键战略目标中取得长足进展,包括在中国扩大商业发展规模,在全球范围内递交多项上市注册申请以改善药物可及性,继续推进涵盖潜在同类第一和自主研发组合用药在内的产品管线,以及进一步提高生物药生产能力。自 3 月 1 日新版国家医保药品目录正式执行以来,公司三款纳入医保目录的创新抗肿瘤药物以及商业化产品线的市场表现令人振奋。此外,公司与诺华达成的授权与合作协议正式生效,也由此获得一笔高达 6.5 亿美元的预付款。不久前,我们还宣布了在针对慢性淋巴细胞白血病的 ALPINE 3 期临床试验的中期分析中,取得了积极结果,进一步展现出百悦泽®的差异化及其成为同类最优药物的潜力。我们相信百济神州能够履行创立之初的使命——为全球数十亿人口提供高质量的药物。”
近期业务亮点及预计里程碑事件
商业运营
- 截至 2021 年 3 月 31 日的三个月,公司全球产品收入共计 1.061 亿美元,相较去年同期的 0.521 亿美元,同比增长 104%。第一季度的产品销售额同比去年同期以及环比上一季度均有涨幅,主要由于公司不断推进产品商业发布的进程,包括自新版国家医保药品目录(以下简称“医保”)2021 年 3 月 1 日正式执行以来,百泽安®、百悦泽®以及安加维®使用患者需求大幅增加,足以抵消上述药品纳入医保后价格下调的净效应
- 第一季度产品收入持续增长,尽管受到一笔 0.242 亿美元付款的负面影响,这是由于百泽安®、百悦泽®和安加维®纳入医保后价格下调,而本季度一些以医保前价格出售的产品仍在分销渠道中,按照惯例,公司支付这笔款项用以补偿经销商,其中大部分与百泽安®相关
- 自百泽安®、百悦泽®以及安加维® 纳入医保以来,医院进院数量显著增加,分别达到纳入医保前的约 4 倍、8 倍和 6 倍
- 尽管新冠疫情对患者治疗方案的影响仍在持续,疫苗接种计划,百悦泽®在美国的销售额仍保持稳定增长
研发项目
百悦泽®(泽布替尼):一款设计旨在最大化靶点占有率、最小化脱靶效应的小分子布鲁顿酪氨酸激酶(BTK)抑制剂,在美国、中国、加拿大和其他国际市场已在特定适应症中获批,目前其在全球范围内更多审批流程正在进行中
- 宣布百悦泽®对比伊布替尼用于治疗成年复发或难治性(R/R)慢性淋巴细胞白血病(CLL)或小淋巴细胞淋巴瘤(SLL)患者的 ALPINE 3 期临床试验(NCT03734016)在中期分析中获得积极结果
- 宣布百悦泽®用于治疗成年华氏巨球蛋白血症(WM)患者在加拿大获批并实现商业化上市,该项获批是基于百悦泽®对比伊布替尼的 ASPEN 3 期临床试验
- 继续在新市场中推进百悦泽®的商业化进程。百悦泽®现已在以色列上市,用于治疗既往至少接受过一种疗法的套细胞淋巴瘤(MCL)患者。迄今为止,百济神州已经在除美国和中国之外的,包括欧盟和 20 多个国家递交了超过 30 项针对多项适应症的注册申请
百悦泽®预计里程碑事件
- 最早将于 2021 年公布百悦泽®对比苯达莫司汀加利妥昔单抗用于治疗初治 CLL 或 SLL 患者的 SEQUOIA 3 期临床试验(NCT03336333)主要结果
- 将于 2021 年在一场重要医学会议上公布 ALPINE 3 期临床试验(NCT03734016)的中期结果,并将于 2022 年公布最终结果
- 继续在全球范围推进百悦泽®的新适应症注册项目,包括 2021 年在中东地区、南美地区、加拿大、澳大利亚和俄罗斯潜在获批用于治疗特定 MCL 患者,以及在美国、欧盟、中国和澳大利亚等地潜在获批用于治疗 WM 患者
- 将于 2021 年完成百悦泽®联合奥比妥珠单抗对比奥比妥珠单抗作为单药用于治疗 R/R 滤泡性淋巴瘤(FL)患者的 ROSEWOOD 全球关键性 2 期临床试验(NCT03332017)患者入组
百泽安®(替雷利珠单抗):一款设计旨在避免与巨噬细胞中 Fc 受体结合、针对免疫检查点受体PD-1 的人源化 IgG4 单克隆抗体。百泽安®在中国已在特定适应症中获批,目前正在全球范围内为获得更多批准进行开发
- 与诺华达成的一项合作与授权协议正式生效,授权诺华在北美、欧洲和日本开发、生产和商业化百泽安®且获得 6.5 亿美元预付款
- 宣布中国国家药品监督管理局(NMPA)药品审评中心(CDE)已受理百泽安®用于治疗接受铂类化疗后出现疾病进展的二或三线局部晚期或转移性非小细胞肺癌(NSCLC)患者的新适应症上市申请(sBLA)
- 一项百泽安®联合和黄医药研发的呋喹替尼针对实体瘤的全球 2 期临床试验(NCT04716634)启动患者入组
- 一项百泽安®与依托泊苷联合或不联合和铂类化疗用于治疗既往未接受过治疗的广泛期小细胞肺癌患者的 3 期临床试验(NCT04005716)已完成全部患者入组
- 在美国癌症研究协会(AACR)2021 年年会的一项口头报告中公布了百泽安®对比多西他赛针对二线或三线局部晚期或转移性 NSCLC 患者的全球 3 期 RATIONALE 303 临床试验(NCT03358875)的中期结果
百泽安®预计里程碑事件
- 与诺华合作,将于 2021 年在中国境外递交首项新药上市许可申请(BLA)
- 将于 2021 年上半年和 2021 年年中在中国分别递交针对 MSI-H / dMMR 实体瘤以及针对二线食管鳞状细胞癌(ESCC)的 sBLA
- 将于 2021 年在中国获批用于治疗一线非鳞状 NSCLC 患者以及获批用于治疗二或三线肝细胞癌(HCC)患者
- 将在美国临床肿瘤学会(ASCO)2021 年线上年会中公布临床数据,包括以下海报展示:
- 一项百泽安®对比化疗用于治疗二线晚期不可切除 ESCC 患者的 RATIONALE 302 临床试验(NCT03430843)
- 一项百泽安®作为单药用于治疗既往接受过治疗的局部晚期不可切除或 MSI-H/ MRD 实体瘤患者的 2 期临床试验(NCT03736889)
- 将于 2021 年公布一项百泽安®联合化疗对比安慰剂联合化疗用于治疗一线鼻咽癌(NPC)患者的 3 期临床试验(NCT03924986)主要结果
- 将于 2021 年完成一项百泽安®对比安慰剂联合放化疗用于治疗局限性 ESCC 患者的 3 期临床试验(NCT03957590)的患者入组
帕米帕利:一款在研高选择性 PARP1 和 PARP2 小分子抑制剂
帕米帕利预计里程碑事件
- 于 2021 年上半年在中国获批用于治疗既往接受过至少两线化疗、伴有胚系 BRCA 突变的复发晚期卵巢癌、输卵管癌或原发性腹膜癌患者
- 将于 2021 年或 2022 年上半年公布帕米帕利作为针对铂敏感复发性卵巢癌(OC)患者维持治疗的 3 期临床试验(NCT03519230)主要结果
- 将在 ASCO 2021 年线上年会上公布临床数据,包括以下海报展示:
- 帕米帕利在中国用于治疗胚系 BRCA 突变的局部晚期或转移性 HER2 阴性乳腺癌患者的 2 期临床试验(NCT03575065)
- 帕米帕利对比安慰剂作为对铂类一线化疗响应的无法手术的局部晚期或转移性胃癌患者维持治疗的 2 期临床试验(NCT03427814)
Ociperlimab (BGB-A1217):一款具有强效 Fc 功能的在研 TIGIT 单克隆抗体
- 在下列临床试验中开展患者入组:
- 一项 ociperlimab 联合百泽安®用于治疗先前接受过治疗的复发或转移性宫颈癌患者的AdvanTIG-202 2 期临床试验(NCT04693234)
- 一项 ociperlimab 联合百泽安®对比百泽安®联合安慰剂用于治疗 PD-L1 高表达的不可切除、局部晚期、复发或转移性 ESCC 患者的 AdvanTIG-203 2 期临床试验(NCT04732494)
Ociperlimab 预计里程碑事件
- 将在 ASCO 2021 年线上年会中公布一项 ociperlimab 联合百泽安®用于治疗晚期实体瘤患者的 1 期剂量递增试验(NCT04047862)的临床数据
- 将于 2021 年上半年启动一项 ociperlimab 联合百泽安®用于治疗 PD-L1 高表达且无 EGFR 敏感突变或 ALK 易位的一线局部晚期、不可切除或转移性 NSCLC 患者的 AdvanTIG-302 全球 3 期临床试验(NCT04746924)的患者入组
- 将于 2021 年启动一项 ociperlimab 联合百泽安®和同步放化疗用于治疗既往未接受过治疗的局部晚期不可切除 NSCLC 患者的全球 3 期 AdvanTIG-301 临床试验(NCT04866017)的患者入组
早期自主研发项目
- 宣布一项在研造血干细胞激酶 1(HPK1)抑制剂 BGB-15025 的 1 期临床试验(NCT04649385)已完成首例患者给药。BGB-15025 的设计旨在成为一款高活性、高选择性的 HPK1 小分子口服抑制剂,代表了一种创新型肿瘤免疫方案,是目前最早进入临床研究阶段的 HPK1 抑制剂之一
- 继续推动早期自主研发管线,包括 BGB-11417(一款针对肿瘤正处于 1 期临床开发的BCL-2 抑制剂)、BGB-A445(一款与百泽安®联合针对实体瘤目前处于 1 期临床开发的非配位体抗 OX40 单克隆抗体),以及 BGB-10188(一款与百悦泽®或百泽安®联合针对肿瘤目前处于 1 期临床开发的 PI3Kδ 抑制剂)
早期自主研发项目预计里程碑事件
- 将于 2021 年启动一项百济神州在研 BCL-2 抑制剂 BGB-11417 针对急性髓细胞性白血病(AML)和骨髓增生异常综合症(MDS)的 1 期临床试验(NCT04771130)。BGB- 11417 的设计旨在成为一款高活性、高选择性的 BCL-2 小分子抑制剂
- 将于 2021 年上半年启动一项 BGB-A425 的 1/2 期临床试验(NCT03744468)的 2 期部分
安进公司合作项目
- BLINCYTO®注射用贝林妥欧单抗针对儿童复发或难治性 B 细胞急性淋巴细胞白血病(ALL)的 sBLA 已在中国被受理并纳入优先审评
其他合作项目
Sitravatinib :一款在研受体酪氨酸激酶(RTK)抑制剂,抑制 TAM(TYRO3、AXL、MERTK)受体家族、分裂受体家族(VEGFR 2 和 KIT)和 RET。百济神州获得 Mirati Therapeutics 授予sitravatinib 在亚洲(不包括日本)、澳大利亚和新西兰的授权
- 在 AACR 2021 年年会上的两项口头报告中公布百泽安®联合与 Mirati Therapeutics 合作开发的 sitravatinib 的临床数据。公布的数据来自一项 1b 期临床试验(NCT03666143)的两个队列,分别用于治疗 PD-1/PD-L1 疗法难治性或耐药性的不可切除或转移性黑色素瘤患者以及用于治疗晚期铂类耐药卵巢癌(PROC)患者
- 完成了一项 Sitravatinib 作为单药治疗和联合百泽安®用于治疗局部晚期或转移性 HCC 或胃/胃食管连接癌(GC / GEJC)患者的 1/2 期临床试验(NCT03941873)患者入组
Sitravatinib 预计里程碑事件
- 将于 2021 年启动一项 sitravatinib 联合百泽安®用于治疗鳞状和非鳞状 NSCLC 患者的 3期临床试验
生产运营
- 宣布 NMPA 已批准广州生物药生产基地用于开展百泽安®的商业化生产。广州生物药生产基地为百济神州全资拥有,占地超过 10 万平方米 (1000000 平方英尺),获批 8000 升产能用于商业化生产,为中国市场生产和商业化供应百泽安®。目前广州生物药生产基地正在进行的另一阶段建设,预计将在 2022 年底前完成,届时,总产能将达到 64000 升
新冠肺炎疫情影响和应对措施
- 公司预计新冠肺炎病毒(COVID-19)引起的世界卫生危机将继续对其业务造成一定的负面影响,包括商业销售、药政沟通、检查及申报、临床试验的患者、参与以及数据公布。该全球大流行对全球的影响仍存在不确定性。公司正在努力减少疫情导致的工作延迟和中断,并继续按照在全球范围内制定的商业化、药政事物以及临床开发目标开展工作
其他发展
- 宣布任命 Julia Wang(王爱军)为首席财务官,于 2021 年 6 月 30 日正式生效。王爱军女士将接任此前宣布将从百济神州退休的梁恒博士。为确保工作有序交接,梁恒博士将留任至 6 月 30 日
- 继续开展在上海证券交易所科技创新板(STAR Market)进行首次公开募集普通股的申请工作,预计将在 2021 年完成。具体时间视市场环境、股东和监管批准情况而定
2021 年第一季度财务业绩
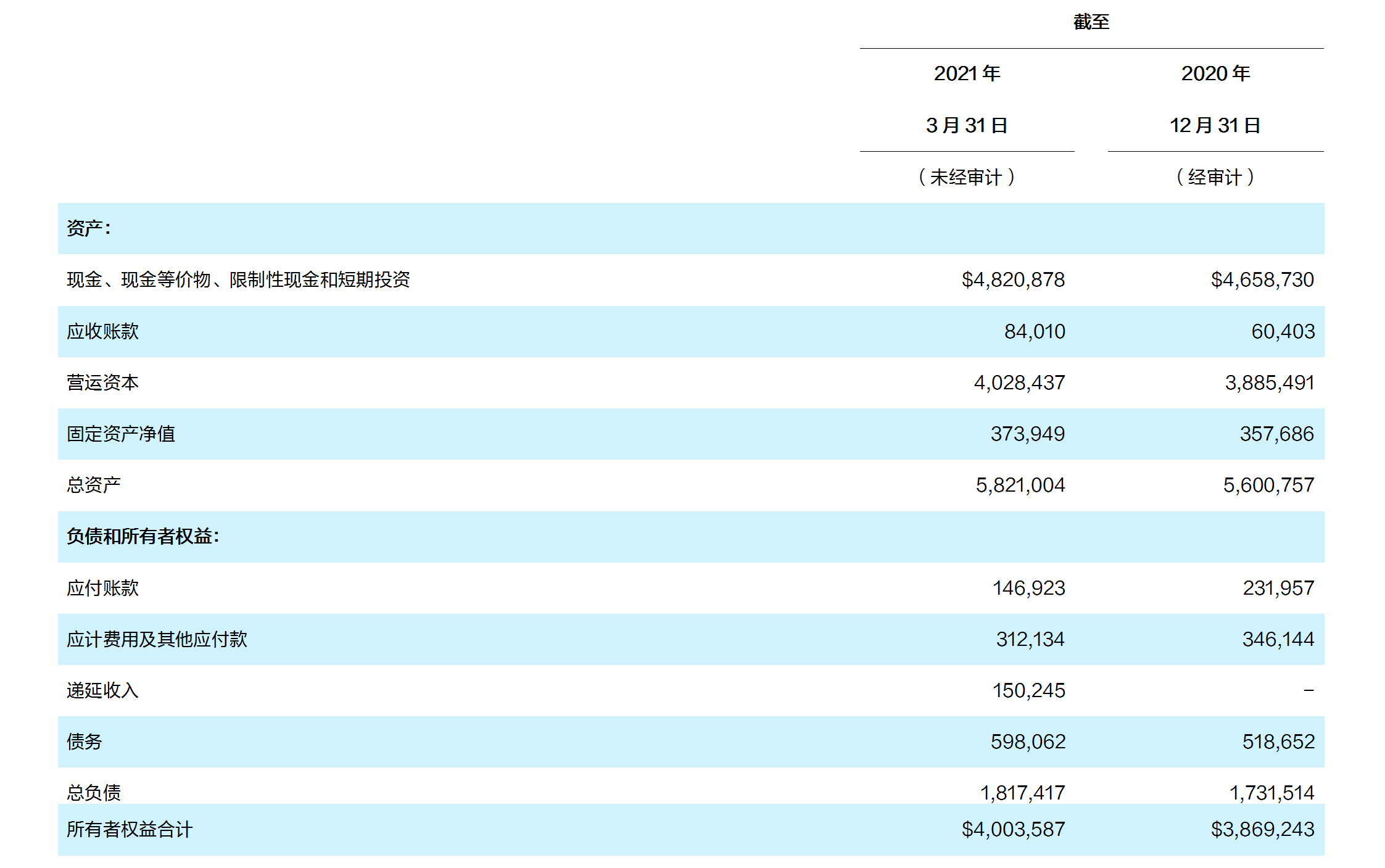
现金、现金等价物、受限资金和短期投资 截至 2021 年 3 月 31 日的三个月现金、现金等价物、受限资金和短期投资为 48 亿美元;相比较, 截至 2020 年 12 月 31 日的持有额为 47 亿美元,实现了 1.621 亿美元的增长
- 截至 2021 年 3 月 31 日的三个月经营活动所用现金为 1.251 亿美元,其中包括与诺华的合作协议作为预付款收到的 6.5 亿美元;资本支出为 0.424 亿美元;支付授权药物预付款所用现金为 0.85 亿美元;募集资金所得现金为 1.074 亿美元, 其中包括银行贷款和员工认股选择权的行使
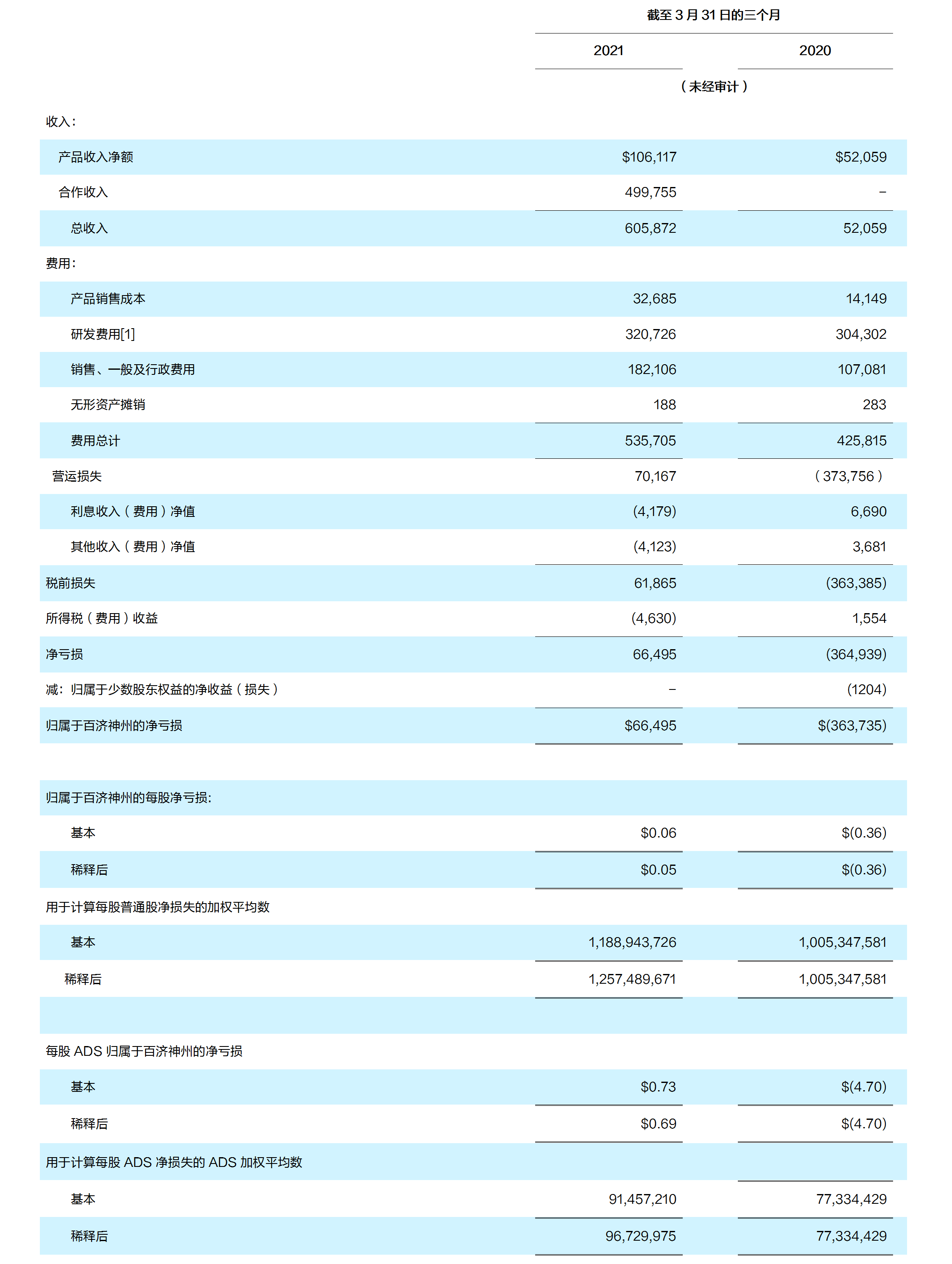
收入 截至 2021 年 3 月 31 日的三个月的收入为 6.059 亿美元;相比较,去年同期收入为 0.521 亿美元
- 截至 2021 年 3 月 31 日的三个月产品收入为 1.061 亿美元;相比较,去年同期为 0.521 亿美元。收入包括:
- 百泽安®在华产品收入为 0.489 亿美元;相比较,去年同期收入为 0.205 亿美元
- 百悦泽®的产品收入为 0.221 亿美元;相比较,去年同期收入为 0.007 亿美元
- 安进公司授权百济神州在华销售的第一款产品安加维®的产品收入为 0.145 亿美元。公司自 2020 年 7 月开始进行安加维®销售活动
- 百时美施贵宝授权在华销售产品的产品收入为 0.203 亿美元;相比较,去年同期为0.308 亿美元。本季度产品收入出现下滑,主要由于在 2020 年 3 月 NMPA 暂停ABRAXANE®供应后,百时美施贵宝实施了相应的产品自愿召回
- 截至 2021 年 3 月 31 日的三个月合作项目收入为 4.998 亿美元,主要来自诺华公司共 6.5亿美元预付款收入的部分确认。去年同期无合作项目收入
费用 截至 2021 年 3 月 31 日的三个月费用为 5.357 亿美元;相比较,去年同期费用为 4.258 亿美元
- 销售成本 截至 2021 年 3 月 31 日的三个月销售成本为 0.327 亿美元;相比较,去年同期为 0.141 亿美元。销售成本增加主要归因于百泽安®、百悦泽®和安加维®产品销售增加, 其中部分与百时美施贵宝公司授权销售产品的销量下滑相抵消
- 研发(R&D)费用 截至 2021 年 3 月 31 日的三个月研发费用为 3.207 亿美元;相比较, 去年同期的研发费用为 3.043 亿美元。研发费用的增加主要归因于用于正在进行以及新启动的后期关键性临床试验持续增长的费用,新增的药物注册登记准备,以及与商业化前活动和供应相关的生产成本。2021 年第一季度,授权候选药物的研发相关预付款为 0.85 亿美元,比去年同期的 0.43 亿美元减少了 0.345 亿美元。2021 年第一季度,研发相关股权奖励支出为 0.219 亿美元;相比较,去年同期为 0.204 亿美元
- 销售、一般及行政管理(SG&A)费用 截至 2021 年 3 月 31 日的三个月销售、一般及行政管理费用为 1.821 亿美元;相比较,去年同期为 1.071 亿美元。销售、一般及行政管理费用的增加主要归因于员工人数的增加,以及公司打造全球布局而不断扩大全球商业团队规模的相关费用增加。2021 年第一季度,销售、一般及行政管理相关的股权奖励支出为0.239 亿美元;相比较,去年同期为 0.179 亿美元
- 净收入 截至 2021 年 3 月 31 日的三个月,净收入为 0.665 亿美元,即每股基本及稀释后收益分别为 0.06 美元和 0.05 美元,或每股美国存托股(ADS)基本和稀释后收益分别为0.73 美元和 0.69 美元;相比较,去年同期净亏损为 3.637 亿美元,即每股 0.36 美元,或每股 ADS 4.70 美元
财务摘要
简要合并资产负债表摘要数据(美国一般公认会计准则)
(单位为 1000 美元)
简要合并营运报表(美国一般公认会计准则)
(除普通股数量、ADS 数量、每股普通股和每股 ADS 数据外,单位为 1000 美元)
[1] 截至 3月 31日的 2021年第一季度和 2020年第一季度研发费用包括正在进行研发的授权药物相关预付款,分别为 0.85亿美元和 0.43亿美元。
关于百济神州
百济神州是一家立足科学的全球生物科技公司,专注于开发创新、可负担的药物,以为全球患者改善治疗效果和提高药物可及性。公司广泛的药物组合目前包括 40 多款临床候选药物,通过强化公司自主竞争力以及与其他公司开展合作,我们致力于加速现有多元、创新药物管线的开发进程,希望能在 2030 年之前为全球 20 多亿人全面改善药物可及性。百济神州在全球五大洲打造了一支近 6000 人的团队。欲了解更多信息,请访问 www.beigene.com.cn。
百济神州前瞻性声明
本新闻稿包含根据《1995 年私人证券诉讼改革法案》(Private Securities Litigation Reform Act of 1995)以及其他联邦证券法律中定义的前瞻性声明,包括有关百济神州候选药物的临床数据以及药品批准,后期临床试验的开展和预计数据公布,计划中新增的产品批准和商业发布,百济神州产品和候选药物预期的临床开发计划、药政注册里程碑和商业化进程,百济神州产品上市成功以及收入增长,公司位于广州的生物制药基地额外建设的预期完成时间表,公司完成上海证券交易所科技创新板首次公开募集普通股的时间表以及是否能够完成,新冠肺炎全球大流行对公司临床开发、商业化运营以及其他业务带来的影响,以及“近期业务亮点和预计里程碑事件”标题下的本公司的计划及预期的事件及里程碑,以及“关于百济神州”标题下的计划、承诺、抱负以及目标。由于各种重要因素的影响,实际结果可能与前瞻性声明有重大差异。这些因素包括了以下事项的风险:百济神州证明其候选药物功效和安全性的能力;候选药物的临床结果可能不支持进一步开发或上市审批;药政部门的行动可能会影响到临床试验的启动、时间表和进展以及药物上市审批;百济神州的上市药物及候选药物(如能获批)获得商业成功的能力;百济神州获得和维护对其药物和技术的知识产权保护的能力;百济神州依赖第三方进行药物开发、生产和其他服务的情况;百济神州取得监管审批和商业化医药产品的有限经验,及其获得进一步的营运资金以完成候选药物开发和实现并保持盈利的能力;新冠肺炎全球大流行对百济神州的临床开发、监管、商业化运营以及其他业务带来的影响;以及百济神州在最近年度报告的 10-K 表格中“风险因素”章节里更全面讨论的各类风险;以及百济神州向美国证券交易委员会期后呈报中关于潜在风险、不确定性以及其他重要因素的讨论。本新闻稿中的所有信息仅及于新闻稿发布之日,除非法律要求,百济神州并无责任更新该些信息。




